Krystalizační jádro – nukleus
Krystalizaci z přesyceného roztoku můžeme vyvolat uměle vložením malého zárodku krystalu nebo libovolné nečistoty. Tato vložená pevná fáze poslouží jako krystalizační jádro (nukleus), na kterém začne krystalizace z roztoku.
Pokud do krystalizace nezasahujeme, dojde v přesyceném roztoku ke spontánnímu vzniku krystalizačních zárodků a následné spontánní krystalizaci. Proces spontánní tvorby zárodků objasňuje Volmerova nukleační teorie.
Vznik zárodku (nuklea) je podmíněn náhodným setkáním více částic rozpuštěné látky, ale spojení těchto částic je bržděno snahou systému o vyrovnání koncentrace v celém objemu (II. věta termodynamiky o vzrůstu entropie). Vznik stabilního zárodku je podmíněn snížením volné energie, která je funkcí objemu a povrchu zárodku. V roztocích nenasycených nebo nasycených znamená vznik zárodku značné zvýšení volné energie, takže jakékoliv seskupení částic rozpuštěné látky se ihned rozpadá.
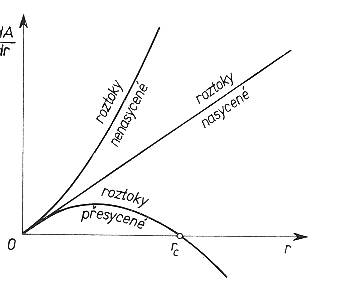
V přesyceném roztoku má funkce volné energie
parabolický průběh a pokud poloměr zárodku překročí určitou kritickou
hodnotu, stává se termodynamicky stabilní a jeho další růst je doprovázen
snižováním volné energie (viz obrázek).

Čím větší je přesycení nebo podchlazení roztoku, tím menší je kritický rozměr zárodků a je tedy pravděpodobnější jejich spontánní vznik. Další krystalizace rozpuštěné látky je provázena zmenšením její koncentrace v roztoku a proces nukleace je tím bržděn.
Jako příklad poslouží krystalizaci halitu. Ionty Na+ a Cl- vytvářejí pravidelné kubické uspořádání. Dochází k náhodnému vzniku mnoha zárodků a zároveň k jejich rozpadu. Pokud některý ze zárodků „přežije“, s jeho postupným růstem se snižuje jeho povrchová energie.